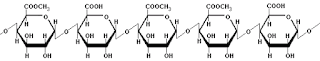Siguiendo con la clasificación de los aminoácidos (que depende del número de átomos de C), tenemos:
a) Diosas (excepción). En este grupo sólo existe un compuesto y algunos científicos ni siquiera lo clasifican como monosacárido puesto que tiene sólo dos átomos de carbono. A este compuesto se le llama glicoaldehído o 2-hidroxietanal.
c) Triosas. Constituidas por tres átomos de carbono. Pueden ser aldotriosas (si tienen un grupo aldehído) o cetotriosas (con un grupo ceto). Su fórmula es, por lo tanto: C3H6O3. Encontramos dos compuestos diferentes: el gliceraldehído y la dihidroxiacetona.
d) Tetrosa. Presentan cuatro átomos de carbono y pueden ser aldotetrosas y cetotetrosas. Su fórmula es C4H8O4. En cuanto a las aldosas, podemos encontrar la la eritrosa o la la treosa. De cetosas, la eritrulosa.
e) Pentosa. Están formadas por cinco átomos de carbono, pudiendo ser aldopentosas o cetopentosas. Su fórmula general es C5H10O5. Encontramos las aldopentosas ribosa, arabinosa, xilosa, lixosa y, como cetopentosas, a la ribulosa y a la xilosa.
f) Hexosa. Compuesta por seis átomos de carbono, difierenciándose las aldohexosas de las cetohexosas. Su fórmula general es, por lo tanto: .En el grupo de las aldosas encontramos a la alosa, altrosa, glucosa, manosa, gulosa, idosa, galactosa y a la talosa. Como cetohexosas, la fructosa, psicosa, sorbosa y a la tagatosa.
Es interesante también mencionar otros monosacáridos con mayor número de átomos de carbono, como pueden ser las heptosas (un ejemplo de heptosa es la sedoheptulosa).
- Propiedades de los monosacáridos.
a) Isomerías. Dos compuestos son isómeros si tienen la misma fórmula molecular. Podemos distinguir diferentes tipos de isómeros:
a.1) Isómeros de posición. Si varía la colocación del grupo funcional. Poniendo un ejemplo no con monosacáridos, sino con alcoholes, podemos tener:
CH3-CH2-CH2OH (1-Propanol)
CH3-CHOH-CH3 (2- Propanol)
a.2) Isómeros de función o químicos. Lo que varía es el grupo funcional. Es decir, un monosacárido tiene un grupo ceto y el otro aldehído. Se cumple, por ejemplo, con la glucosa y la fructosa.
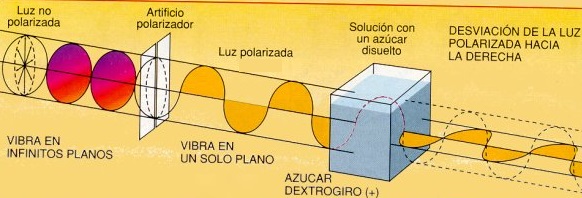
a.3) Isómeros ópticos. Los monosacáridos en disolución pueden desviar el plano de luz polarizada dependiendo de la posición relativa del grupo hidroxilo (-OH). Si se desvía hacia la derecha, es una forma dextrógira o "+"; si se desvía hacia izquierda, es una forma levógira o "-".
La radiación electromagnética, como la luz visible, se transmite en forma de ondas que tienen varias direcciones. Sin embargo, al pasar por un instrumento llamado polarizador, la onda sólo se transmite en una dirección.
Los monosacáridos en disolución pueden desviar la dirección de la luz ya polarizada:
a.4) Isómeros geométricos o estereoisómeros. Si tienen la misma fórmula
molecular pero diferente estructural.
Para explicar esto, debemos recordar lo que es un carbono asimétrico o centro quiral: un carbono coordinado con cuatro grupos diferentes.
También debemos definir lo que es una molécula quiral. Es aquella que no es superponible. Como ejemplo sencillo tenemos las manos: si yo coloco la mano izquierda sobre la derecha, no coinciden, no son superponibles. Son, por lo tanto, elementos quirales:
Pero dentro de los elementos quirales debemos destacar los especulares. Son aquellos que no son superponibles porque cada uno representa el reflejo en un espejo del otro:
Centrándonos ya en los estereoisómeros, podemos distinguir:
- Enantiómeros. Si son imágenes quirales (no superponibles) y especulares (se ve todo al revés, como visto a través de un espejo). Por convención, si el grupo hidroxilo se encuentra a la derecha en
la proyección de Fisher (es la forma de representar las moléculas como hemos estado haciendo hasta ahora), es una forma D. Si se encuentra a la izquierda, una
forma L.
 |
| D-Glucosa y L-Glucosa, respectivamente |
- Diastereoisómeros. Si son
moléculas quirales (no superponibles) pero no enantiómeros. Es decir, se
diferencian en uno o más centros quirales diferentes del que determina la
enantiomería. En este grupo entran, entre otros, los epímeros (difieren en 1 C
asimétrico diferente del de la enantiomería), como ocurre con la glucosa y la galactosa:
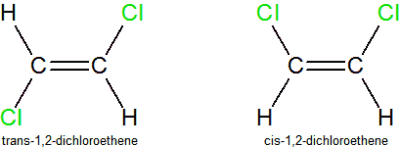
También están incluidos en el grupo de los diastereoisómeros los isómeros cis-trans (los cis
tienen los sustituyentes al mismo lado del doble enlace; los trans en lados
opuestos).
Poniendo un ejemplo real:
- Anómeros. En las disoluciones de D-Glucosa
se observaron ciertas anormalidades. Por una parte, su grupo aldehído era
relativamente estable ante sustancias que reaccionan con ese grupo. Y, por otra
parte, la rotación óptica (rotación de la polarización de la luz) variaba de 112º y 13º hasta estabilizarse, pasados
unos minutos, en 52,7º.
Estas anormalidades se explicaban si los científicos tenían en cuenta la formación de los anómeros. Los monosacáridos en
disolución ciclan formando anillos de pirano o de furano.
A este fenómeno se le denomina ciclación. Sólo pueden ciclarse las aldopentosas y las hexosas.
Para la ciclación de una molécula han de seguirse los siguientes pasos (en este caso se hará con una molécula de glucosa).
 |
| Molécula de D-Glucosa |
1. Se tumba (abate) la molécula
2. Comienza el plegamiento
3. Tiene lugar el impedimento esteárico (la molécula es demasiado grande como para finalizar el plegamiento), por lo que tiene lugar una rotación.
4. Enlace hemiacetal. Éste tiene lugar entre el OH del quinto carbono y el grupo aldehído. Se cierra entonces el ciclo mediante un enlace C - O - C. Se rompe el doble enlace del aldehído para formar un grupo hidroxilo. El primer carbono determina la anomería en función de la posición del OH (hidroxilo), como se verá a continuación. Además, éste se convierte en un carbono asimétrico o centro quiral.
Viendo el proceso de seguido:
A este tipo de representaciones de las moléculas se les llama proyección de Haworth. Si el grupo hidroxilo del carbono anomérico se encuentra en la parte superior de esta
proyección, es una forma beta. Si se encuentra abajo, es una forma alfa.
 |
Proyección de Haworth de la
β-D-glucopiranosa
|
La variación de la rotación óptica de la disolución de la que antes hablábamos se explica porque, pasados unos minutos, en la
disolución acaba habiendo 1/3 de α-D-glucopiranosa y 2/3 de β-D-Glucopiranosa. A esto
se le denomina mutarrotación (conversión de un tipo de glucopiranosa en otro). Por otro parte, la relativa inactividad de la disolución se debe a la rotura del grupo aldehído que tiene lugar en este proceso.
- Propiedades químicas de los monosacáridos.
Es de suma importancia el poder reductor. Un monosacárido tiene poder reductor
ya que tiene el carbono anomérico libre. Recordemos que una molécula reduce a otra si se ella misma se oxida: perdiendo H2, e- o ganando O. En caso de tener poder reductor, da positivo ante
reactivos como el de Fehling, Tollens o Benedict.
- Propiedades físicas de los monosacáridos.
Son dulces,
blanquecinos, cristalinos, solubles en agua…
- Derivados de los monosacáridos.
Podemos distinguir varios tipos:
a) Glucósidos. Son moléculas formadas por un
glúcido y otra molécula de naturaleza diferente unidos por un enlace
O-glucosídico, que supone la pérdida de una molécula de agua.
 |
| Enlace O-Glucosídico |
A la parte
glucídica, que puede ser o un monosacárido o un conjunto de ellos, se le
denomina glicona. A la parte no glucídica, genina o aglicona.
Encontramos
varios tipos de glucósidos, entre los que destacan: glucósidos alcohólicos
(ejemplo: salicina, que se encuentra en las plantas del género Sálix y que al
ser ingerido se transforma en ácido salicílico); cianogénicos (la aglicona es cianuro,
que en el organismo puede derivarse en ácido cianhídrico. Ejemplo: amigdalina,
sustancia que se encuentra en las almendras. Estos aparecen en frutos y hojas
marchitas de almendros, perales, manzanos, albaricoqueros…); saponinas
(producen una espuma permanente que puede llegar a causar la muerte de los
glóbulos rojos por hemólisis. Se usa en la industria como expectorante, y en
aceites y detergentes).
b) Azúcares alcoholes o Polialcoholes. Los monosacáridos,
al tener un grupo aldehído o ceto, pueden reaccionar con el H2,
reduciéndose y dando lugar a azúcares alcoholes. Ejemplos de ellos son el
maltitol, lactitol, glicerol (también conocido como glicerina), sorbitol, eritritol…
 |
| Maltitol |
Éstos tienen un contenido
calórico menor que la sacarosa (aproximadamente 2,4 kcal/g y 4 kcal/g, respectivamente)
y son ligeramente menos dulces. De hecho, los de cadena corta como el glicerol,
en altas cantidades resultan amargos.
Al ser calentados no se ponen marrones
como otros azúcares. Tienen igualmente un poco fermentabilidad, por lo que no
favorecen la placa bacteriana bucal. Si a
esto le sumamos que algunos, como el sorbitol [E-420], producen una sensación
de frescor (quemestesis), es fácil comprender que sean utilizados como
edulcorantes sustituyendo a la glucosa en diversos productos (chicles, pastas
dentríficas)…
 |
| Composición de unos chicles |
Los azúcares alcoholes, o polialcoholes, tienen un bajo nivel de absorción en el intestino
delgado, por lo que apenas alteran los niveles de glucosa y pueden ser
ingeridos por diabéticos. Esta baja absorción da lugar a efectos secundarios
como la hinchazón o la diarrea (en los chicles, por ejemplo, se avisa que un consumo excesivo puede tener efectos laxantes). El eritritol, que sí que se absorbe a nivel
intestinal, es el único que no origina estos efectos.
c) Amino azúcares. En éstos, un
grupo amino o acetilamino se ha unido a un OH. Ejemplos de estos son la
Glucosamina, Galactosamina, N-Acetilglucosamina, N-Acetilgalactosamina.
d) Azúcares ácidos. En estos un
grupo hidroxilo ha sido oxidado para dar lugar a un grupo carboxilo. Ejemplos
de estos son los ácidos aldónicos (ácido ascórbico, ácido glucónico) o los ácidos
urónicos (ácido glucurónico, ácido galacturónico)…
 |
| Ácido glucurónico |
e) Desoxiazúcares. En éstos un
grupo hidroxilo ha sido sustituido por un H. El más importante es el
2’Desoxirribosa, que forma parte de los ácidos nucleicos.
 |
b-D-Ribofuranosa (izquierda) y b-D-Desoxirribofuranosa (derecha)
|
f) Azúcares fosfato. Son aquellos
que han sido fosforilados; es decir, a un grupo hidroxilo se le ha unido mediante un
enlace éster un fosfato [H3PO4
(Ácido fosfórico) → H3+ + PO43-
(fosfato)].
2. Ósidos. Son aquellos compuestos que sí que se pueden dividir en elementos más simples (en monosacáridos). Están formados, por lo tanto, por la unión (polimerización) de varias de esas subunidades (osas o monosacáridos).
Podemos distinguir entre holósidos (formados sólo por monosacáridos) y heterósidos (formados por azúcares y otro resto que no lo es).
a) Holósidos. En los holósidos encontramos a los oligosacáridos (formados por la unión de entre 2-10 monosacáridos) y polisacáridos (más de 10 monosacáridos unidos).
a.1) Oligosacáridos. Los oligosacáridos más importantes son los llamados "oligosacáridos menores" o disacáridos, compuestos por dos monosacáridos unidos por un enlace O-Glucosídico (mencionado previamente con los glucósidos, derivados de los monosacáridos), que implica la périda de una molécula de agua. Los disacáridos más importantes son:
- Glucosa + Glucosa = Maltosa (α-D-Glucopiranosil
(1, 4) α- D - Glucopiranosa)
- Glucosa + Galactosa = Lactosa (β-D-Galactofuranosa
(1, 4) β-D-Glucofuranosa)
- Glucosa + Fructosa = Sacarosa (α-D-Glucopiranosil
(1,2) β-D- Fructofuranosa)
Los
discáridos tienen poder reductor si y sólo si tienen un C anomérico libre
Basándonos en esto, podemos concluir que la maltosa y la lactosa sí que tienen poder reductor, pero la sacarosa no.
a.2) Polisacáridos. Están formados por la unión de más de 10 monosacáridos. Se pueden clasificar dependiendo
de la función en estructurales y energéticos; y dependiendo de la composición,
en homopolisacáridos (sucesión del mismo monosacárido) y heteropolisacáridos
(sucesión de diferentes monosacáridos).
- Polisacáridos energéticos.
· Almidón. Homopolisacárido
formado por la unión de α-d-Glucosas. Es el polisacárido de reserva
energética a corto plazo en vegetales. Está formado por dos componentes: la
amilosa, componente lineal (que sea un componente lineal no significa que tenga la forma de una línea recta, sino sólo que no está ramificado; es decir, que no surgen de la cadena principal otros brazos de glucosa) que se enrolla en forma de hélice y que está formada
por una sucesión de α-D-glucosas con enlaces (1, 4); y la amilopectina,
componente ramificado formado por la sucesión de 25 – 30 α-D-glucosas con
enlaces (1, 4) y un enlace (1, 6) que lo une con otra cadena de α-D-Glucosas
(1 , 4).

· Glucógeno. Homopolisacárido
formado por la sucesión de α-D-Glucosas. Es el polisacárido de reserva energética a corto plazo en animales. Tiene una estructura similar a la
amilopectina, sólo que es más ramificado [enlaces (1, 6)] ya que éstas
ocurren cada 8 – 12 α-D-Glucosas (1, 4). En el
centro de la molécula de glucógeno se encuentra una molécula de naturaleza
proteica, la glucogenina, a la cual se unen las glucosas que se van enlazando y
ramificándose por acción de la enzima amilo sintetasa. Éste se almacena en músculo (1-2% del peso muscular), en las células del hígado o hepatocitos (representando el 8-10% del peso total), en bajas cantidades en los eritrocitos (glóbulos rojos sanguíneos), riñones, y en cantidades aún más bajas, en algunas células gliales y en glóbulos blancos.
 |
Molécula de glucógeno
En el centro aparece una molécula de naturaleza proteica: glucogenina |
· Dextranos. Homopolisacárido
formado por la sucesión de α-D-Glucosas (1, 6) encargado de la reserva energética en bacterias y levaduras. En medicina se utiliza, por ejemplo, para
disminuir la viscosidad de la sangre.
· Fructanos o Fructosanos. Heteropolisacáridos
formado por la sucesión de glucosas y fructosas (1 glucosa + 3 fructosas);
dependiendo del número de veces que se repita esta unión tenemos un
polisacárido u otro (inulina, levana…). Éstos se encuentran en tallos de
algunas plantas a las que protegen de las bajas temperaturas.
 |
| Inulina - Fructosano |
- Polisacáridos estructurales
· Celulosa. Homopolisacárido formado por la sucesión de β-glucosas
(1, 4). Las fibras de glucosa están unidas entre sí por hemicelulosa,
pectina y extensina. Debido a la estructura de la celulosa, abundan los puentes
de hidrógeno, por lo que es más difícil romper su estructura y confieren
resistencia y rigidez a las paredes de
las células vegetales, que es donde se encuentra.
La madera está formada por un 50% de celulosa; el algodón es la sustancia con mayor concentración, un 90%. Por la misma razón de antes, no es fácil digerir la celulosa, el ser humano apenas puede, por lo que es importante para depurar y limpiar el organismo. Otros seres vivos, como los rumiantes, por ejemplo, están en simbiosis con organismos que sí pueden digerirla [gracias a unas enzimas llamadas celulasas]. El resultado de su metabolismo es la celobiosa.
 |
| Celulosa bajo el microscopio |
· Hemicelulosa. Es un Heteropolisacárido formado por la sucesión
de D-Manosa, D-xilosa, D-Glucosa y D-Galactosa.
· Pectina. Homopolisacárido formado por la sucesión de
ramnogalacturonanos (I y II) y homogalacturonanos. En la industria es utilizada
como espesante (E-440).
· Quitina. Homopolisacárido formado por la sucesión de
N-Acetilglucosamina. Forma el exoesqueleto de los artrópodos.
También aparece en la pared de los hongos.
 |
| Estructura de la pared fúngica |
· Ácido hialurónico. Heteropolisacárido formado por la sucesión de
N-acetilglucosamina y ácido glucorónico. Forma parte del humor vítreo (fluido gelatinoso y transparente que rellena el espacio comprendido entre la
superficie interna de la retina y la cara posterior del cristalino), tejido
conjuntivo y sinovia (líquido viscoso que se
encuentra en las articulaciones).
· Condroitina. Heteropolisacárido formado por la sucesión de
ácido glucorónico y N-acetilgalactosamina. Aparece en el tejido cartilaginoso.
 |
| Tejido cartilaginoso |
· Agar Agar. Heteropolisacárido formado por la sucesión de L-Galactosa y
D-Galactosa. Aparece en las algas rojas (Rhodophytas). Es utilizado como
espesante y laxante; en los laboratorios, como nutriente y soporte de cultivos.
 |
| Rhodophyta |
· Goma arábiga. Heteropolisacárido formado por la sucesión de
D-Arabinosa y D-Galactosa. Es sintetizado por las acacias para cerrar heridas.
Era utilizado por los antiguos egipcios durante la momificación. Actualmente se
utiliza como espesante (E-414).
 |
Acacia Dealbata
Algunas acacias pliegan sus hojas al anochecer, por lo que se les denomina "mimosas" |
· Heparina. Heteropolisacárido que actúa como anticoagulante. Formado,
en su mayoría, por 2-sulfato ácido idurónico y 6-sulfato N-acetilglucosamina.
b) Heterósidos. Son aquellos que están formado por una parte glucídica y otra de naturaleza diferente. Podemos encontrar:
b.1) Glucoproteínas. El componente proteico domina sobre el glucídico. Por ejemplo, en los receptores celulares, autoantígenos (como los que determinan los grupos sanguíneos) o en los anticuerpos.
 |
| Estructura de un anticuerpo |
b.2) Peptidoglicano. Formado por N-acetil-glucosamina
y el Ácido N-acetilmurámico unidos mediante enlaces β-1,4. Forman parte de la pared de las bacterias, a las que protegen en ambientes húmedos de ruptura osmótica.
 |
Estructura del peptidoglicano o peptidoglucano
NAG = N-AcetilGlucosamina; NAM = N-AcetilMurámico |
FUNCIONES DE LOS GLÚCIDOS:
1. Función estructural
2. Reserva energética
3. Forman parte de los receptores celulares
4. Forman parte de los ácidos nucleicos.